Impfstrategien: Wie Adjuvantien die Qualität der induzierten Antikörper beeinflussen
Ein Forschungsteam unter Beteiligung von Mitgliedern des Exzellenzclusters PMI hat untersucht, welchen Einfluss verschiedene Impfstoff-Strategien auf die Qualität und Quantität der induzierten IgG-Antikörper haben.
Zurzeit läuft die Entwicklung von Impfstoffen gegen das neuartige SARS-CoV-2 Virus auf Hochtouren. Dabei steht häufig die Induzierung von sogenannten Immunglobulin-G (IgG)-Antikörpern, insbesondere von „neutralisierenden“ IgG-Antikörpern im Fokus, die das Andocken des Virus an spezifische Oberflächenproteine auf menschlichen Zellen verhindern. Bei der Berichterstattung bleibt jedoch oft unerwähnt, dass Impfungen verschiedene Immunzellen beeinflussen, und sich die Qualität der entstehenden Antikörper - neben dem Neutralisationspotential - noch weiter unterscheiden kann. Hilfsmittel, die Impfstoffen zur Verstärkung der Immunantwort zugegen werden, können diese Immunantwort und auch die Menge und Art der Antikörper viel stärker als lange angenommen beeinflussen. Wie sich diese Co-Stimulatoren oder Adjuvantien in den Impfstoffen auf die Immunantwort und die Qualität und Quantität der IgG-Antikörper auswirken, hat ein Forschungsteam unter Beteiligung des Exzellenzclusters „Precision Medicine in Chronic Inflammation“ (PMI) untersucht. Die Ergebnisse haben die Forschenden um Professor Marc Ehlers, Mitglied im Exzellenzcluster PMI und Arbeitsgruppenleiter „Immunologie und Glykoanalytik“ am Institut für Ernährungsmedizin (IEM) der Universität zu Lübeck, jetzt in der renommierten Wissenschaftszeitschrift „The Journal of Allergy and Clinical Immunology“ veröffentlicht.
Neutralisierende IgG Antikörper blockieren das Andocken z.B. eines Virus an ein Oberflächenprotein auf den menschlichen Zellen und verhindern so das Eindringen und die Vermehrung des Virus. Die neutralisierende Wirkung wird dabei durch den vorderen Teil (Fab-Teil), den Gabelähnlichen Teil des Y-förmigen Antikörpers vermittelt, der an den Erreger bindet. Zusätzlich können die Y-förmigen Antikörper aber auch noch über ihren hinteren sogenannten Fc-Teil Immunzellen aktivieren, die dann helfen, das Virus zu zerstören. Dieser Fc-Teil kann unterschiedlich beschaffen sein, abhängig vom Subtyp (IgM, IgG1, IgG2, IgG3, IgG4, IgA1, IgA2, IgE) des Antikörpers und von der Art der Zuckerbausteine, die an diesen Teil angeknüpft sind. Beides beeinflusst, wie der Antikörper mit Rezeptoren auf Immunzellen interagiert und diese dann aktiviert.
Es gab bereits Hinweise darauf, welche Fc-Verzuckerungen die Aktivierung von Immunantworten begünstigen: So tragen bei entzündlichen Autoimmunerkrankungen die für die Patientinnen und Patienten gefährlichen IgG-Antikörper, die sich gegen den eigenen Körper richten, weniger häufig den Baustein Sialinsäuren in ihrem Fc-Zuckergerüst. Auf diesen Erkenntnissen aufbauend vermuten die Forschenden, dass solche IgG-Antikörper ohne Sialinsäuren besser in der Lage sind Immunzellen zu aktivieren, um Viren und Bakterien anzugreifen.
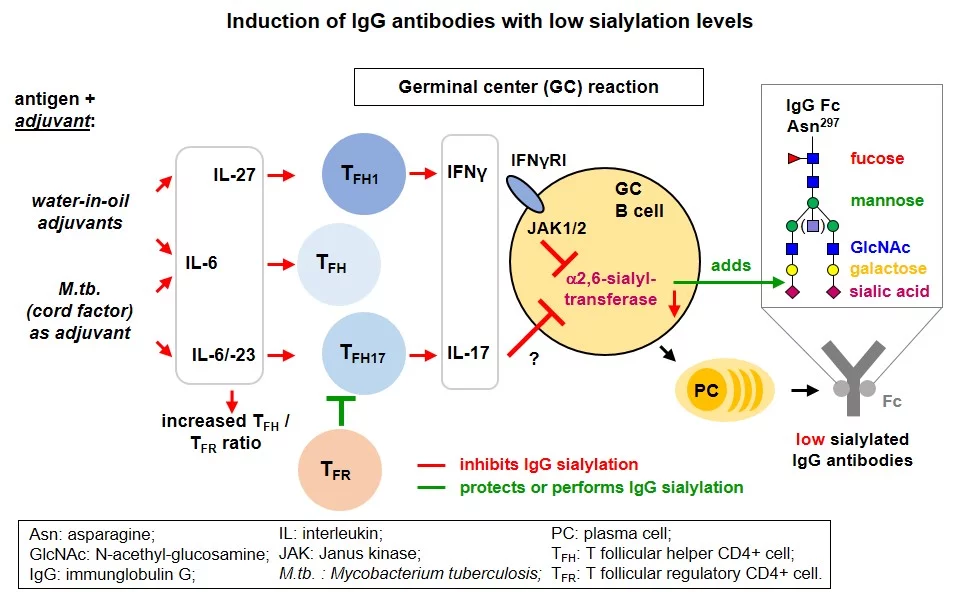
„Die Frage ist also, wie man es bei einer Impfung schafft, genau solche effektiveren Fc-Verzuckerungen zu erreichen“, sagt Prof. Ehlers. Das Team hat daher untersucht, wie sich verschiedene Adjuvantien in Impfstoffen auf die Art der Fc-Verzuckerung der entstehenden IgG-Antikörper auswirken. Sie konnten zeigen, dass es diesbezüglich große Unterschiede zwischen den getesteten Adjuvantien gibt. Diese Unterschiede entstehen dort, wo die Adjuvantien die Immunantworten von CD4+ T-Zellen und B-Zellen beeinflussen: in den sogenannten Keimzentren. Definierte Adjuvantien induzieren dort also bestimmte Immunantworten, die wiederum zu bestimmten Verzuckerungen in den Fc-Teilen der Antikörper führen.
„Wenn wir genauer verstehen, wie wir besonders effektive Verzuckerungen des Fc-Teils der IgG Antikörper durch bestimmte Adjuvantien oder andere Impfstrategien erzielen können, können wir zukünftig wirksamere Impfungen entwickeln und die Impfstrategien in diese Richtung anpassen“, erklärt Prof. Ehlers. In diesem Zusammenhang interessiert ihn auch, wie definierte IgG-Fc-Verzuckerungen andere Immunzellen beeinflussen.
„In Bezug auf die aktuelle Corona-Pandemie und die derzeit laufende Impfstoffentwicklung, wird es nun spannend sein, zu verfolgen, ob z.B. SARS-CoV-2-Infizierte mit keinen oder milden Symptomen eine für die Immunabwehr effektivere Fc-Verzuckerung der IgG-Antikörper zeigen als Erkrankte mit schweren Symptomen. Denkbar wäre aber auch, dass die Bildung von IgG-Antikörpern mit zu aggressiver Verzuckerung im Fc Teil zu Entzündungen in der Lunge beiträgt“, so Ehlers weiter. Dies müsse zukünftig genauer untersucht werden. „Weiter spannend wird nun sein zu verfolgen, wie verschiedene Impfstoff-Strategien gegen das SARS-CoV-2 Virus die IgG-Antikörper-Verzuckerung beeinflussen und welche IgG-Fc-Verzuckerung mit dem besten Schutz korreliert“, so Ehlers weiter.
Kontakt:
Prof. Dr. rer. nat. Marc Ehlers
Institut für Ernährungsmedizin
Universität zu Lübeck und Universitätsklinikum Schleswig-Holstein
0451/3101-8410
Marc.Ehlers@uksh.de
Schematische Übersicht der Ergebnisse. Impfstrategien mit Protein-Antigenen und dem oft verwendeten Adjuvanz Aluminiumhydroxid (Alum) induzieren IgG Antikörper, die häufig Sialinsäuren in ihrem Fc-gekoppelten Zuckergerüst tragen. Stattdessen induzieren Wasser-in-Öl Adjuvantien oder zum Adjuvanz hinzugefügte tote Mycobakterien IgG Antikörper, die weniger häufig Sialinsäuren tragen. Die Entscheidung, welche Zuckerbausteine an die induzierten IgG Antikörper während ihrer Produktion in den B-Zellen angeknüpft werden, findet in den Keimzentren (germinal centers) statt, wo Antigen-spezifische CD4+ T Zellen und B Zellen miteinander kommunizieren.
Originalpublikation:
Bartsch YC*, Eschweiler S*, Leliavski A*, Lunding H*, Wagt S*, Petry J, Lilienthal G-M, Rahmöller J, de Haan N, Hölscher A, Erapaneedi R, Giannou AD, Aly L, Sato R, de Neef LA, Winkler A, Braumann D, Hobusch J, Kuhnigk K, Krémer V, Steinhaus M, Blanchard V, Gemoll T, Habermann J, Collin M, Salinas-Riesters G, Manz R, Korn T, Fukuyama H, Waisman A, Yogev N, Huber S, Rabe B, Rose-John S, Busch H, Berberich-Siebelt F, Hölscher C, Wuhrer M, and Ehlers M. IgG Fc sialylation is regulated during the germinal center reaction upon immunization with different adjuvants. J Allergy and Clinic Immunol. 2020 (https://doi.org/10.1016/j.jaci.2020.04.059); *diese Autoren trugen in gleichem Maße zur Publikation bei; alphabetische Reihenfolge.
Über den Exzellencluster PMI
Der Exzellenzcluster „Präzisionsmedizin für chronische Entzündungserkrankungen/Precision Medicine in Chronic Inflammation“ (PMI) wird von 2019 bis 2025 durch die Exzellenzstrategie des Bundes und der Länder gefördert (ExStra). Er folgt auf den Cluster Entzündungsforschung „Inflammation at Interfaces“, der bereits in zwei Förderperioden der Exzellenzinitiative (2007-2018) erfolgreich war. An dem neuen Verbund sind rund 300 Mitglieder in acht Trägereinrichtungen an vier Standorten beteiligt: Kiel (Christian-Albrechts-Universität zu Kiel, Universitätsklinikum Schleswig-Holstein, Muthesius Kunsthochschule, Kiel Institut für Weltwirtschaft (IfW) und Leibniz-Institut für die Pädagogik der Naturwissenschaften und Mathematik), Lübeck (Universität zu Lübeck, Universitätsklinikum Schleswig-Holstein), Plön (Max-Planck-Institut für Evolutionsbiologie) und Borstel (Forschungszentrum Borstel - Leibniz Lungenzentrum).
Ziel ist es, die vielfältigen Forschungsansätze zu chronisch entzündlichen Erkrankungen von Barriereorganen in ihrer Interdisziplinarität verstärkt in die Krankenversorgung zu übertragen und die Erfüllung bisher unbefriedigter Bedürfnisse von Erkrankten voranzutreiben. Drei Punkte sind im Zusammenhang mit einer erfolgreichen Behandlung wichtig und stehen daher im Zentrum der Forschung von PMI: die Früherkennung von chronisch entzündlichen Krankheiten, die Vorhersage von Krankheitsverlauf und Komplikationen und die Vorhersage des individuellen Therapieansprechens.
Pressekontakt:
fbuhse@uv.uni-kiel.de0431/880 4682 https://precisionmedicine.de
Exzellenzcluster „Präzisionsmedizin für chronische Entzündungserkrankungen“
Wissenschaftliche Geschäftsstelle
Leitung: Dr. habil. Susanne Holstein
Christian-Albrechts-Platz 4, D-24118 Kiel
Sonja Petermann
0431/880-4850, Telefax: 0431/880-4894
spetermann@uv.uni-kiel.de
Twitter: PMI @medinflame