Umfangreiche Gen-Studie bringt neue Erkenntnisse zu den Ursachen von „Hämorrhoiden“
DNA-Analysen von fast einer Million Menschen erlauben internationalem Forschungsteam unter Beteiligung des Exzellenzclusters PMI Einblicke in Krankheitsmechanismen der bisher kaum erforschten Volkskrankheit.
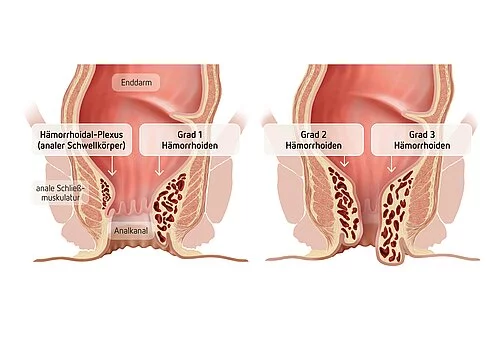
Hämorrhoiden sind blutgefüllte Polster am Ende des Verdauungstraktes, die dazu dienen den After zu verschließen und den Stuhlgang zu kontrollieren. Umgangssprachlich bezeichnet man mit Hämorrhoiden oft auch die krankhafte Vergrößerung und Ausstülpung dieser Polster. Bei dieser formal als Hämorrhoidalleiden bezeichneten Erkrankung schwellen die Hämorrhoiden an, was zu Juckreiz, Brennen und Blutungen führen kann und den Alltag teilweise massiv einschränkt. Häufig bleibt es bei einer milden Ausprägung, die mit konservativen Maßnahmen behandelt werden kann. Fortgeschrittene, symptomatische Stadien hingegen sind mit erheblichen Einschränkungen verbunden und erfordern dann eine chirurgische Behandlung. Die Erkrankung wurde bereits in der Antike beschrieben und betrifft heute Schätzungen zu Folge einen großen Teil der Bevölkerung, auch wenn hierzu genaue Angaben fehlen. Trotzdem ist das Hämorrhoidalleiden wenig erforscht – möglicherweise auch, da es ein Tabuthema ist, über das nur ungerne gesprochen wird. Sowohl die genauen molekularen Mechanismen als auch die Gründe, warum nur manche Menschen ein ausgeprägtes Hämorrhoidalleiden entwickeln, sind bisher ungeklärt. Zu möglichen Risikofaktoren zählen vermehrtes Sitzen, Übergewicht, ballaststoffarme Ernährung, übermäßig lange Toilettengänge oder zu starkes Pressen sowie das Heben von schweren Gegenständen. Allerdings gibt es bisher dazu keine eindeutigen wissenschaftlichen Erkenntnisse. Ein internationales Forschungsteam unter Beteiligung des Exzellenzclusters „Precision Medicine in Chronic Inflammation“ (PMI) konnte nun anhand von genetischen Analysen wichtige Erkenntnisse über dieses Volksleiden liefern. Ihre Ergebnisse haben sie vor kurzem in der renommierten Fachzeitschrift Gut veröffentlicht.
Die Forschenden haben dazu Erbinformationen von 218.920 Patientinnen und Patienten mit Hämorrhoidalleiden und 725.213 Vergleichspersonen untersucht. Sie griffen dabei auf eingelagerte Proben aus verschiedenen großen populationsbasierten Kohorten zurück, also für die Gesamtbevölkerung repräsentative Sammlungen von Bioproben. Durch die Analysen konnten sie 102 Regionen im menschlichen Genom identifizieren, die Gene enthalten, die zu einem erhöhten Risiko für Hämorrhoidalleiden beitragen – also sogenannte Risikogene. Bis dahin war noch kein einziges Risikogen bekannt.
Hinweise zu Krankheitsmechanismen
Zusätzlich haben die Forschenden Zellen aus Hämorrhoiden-Gewebeproben analysiert, die bei Operationen entnommen worden waren. Dabei haben sie die Proteinprodukte, für die die neu entdeckten Risikogene kodieren, direkt im menschlichen Hämorrhoidalgewebe nachgewiesen und damit gezeigt, in welchen Bereichen die Risikogene aktiv sind. Dadurch konnten sie erstmals Hinweise darauf finden, welche Funktionen bei der Erkrankung möglicherweise gestört sind und zu den Symptomen führen. „Unsere Ergebnisse deuten darauf hin, dass das Hämorrhoidalleiden zumindest teilweise aus einer Fehlfunktion der glatten Muskulatur, der Blutgefäße und des Bindegewebes in diesem Bereich resultiert. Damit haben wir erste Hinweise auf mögliche Krankheitsmechanismen dieser bisher so unzureichend charakterisierten Volkskrankheit. Langfristig könnte das bei der Entwicklung zusätzlicher nicht-invasiver Therapieoptionen helfen“, sagt einer der federführenden Autoren, Professor Andre Franke, Mitglied im Exzellenzcluster PMI und Direktor des Instituts für Institut für Klinische Molekularbiologie (IKMB) der Christian-Albrechts-Universität zu Kiel (CAU) und des Universitätsklinikums Schleswig-Holstein (UKSH), Campus Kiel. Bisher werden Hämorrhoidalleiden schwereren Grades überwiegend chirurgisch, also durch Entfernen des überschüssigen Gewebes entfernt. Ein besseres Krankheitsverständnis könnte zukünftig auch zur Entwicklung von Therapien beitragen, die direkt an möglichen Ursachen ansetzen.
Hohes Erkrankungsrisiko frühzeitig erkennen
Aus den identifizierten Risikogenen haben die Forschenden sogenannte polygene Risikoscores (PRS) berechnet. Diese Werte geben für Kombinationen mehrerer Risikogene jeweils das Risiko für ein Hämorrhoidalleiden an. Um diese rechnerisch gewonnenen Risikoscores zu testen und ihre Korrektheit zu bestätigen, haben sie diese an genetischen Daten von Patientinnen und Patienten überprüft, die nicht in der ursprünglichen Analyse eingeschlossen waren. Die Erkrankten, die alle schwerere Ausprägungen des Hämorrhoidalleidens hatten, waren klinisch ausführlich charakterisiert, so dass die Risikoscores mit den realen klinischen Daten abgeglichen werden konnten. Es zeigte sich, dass höhere Werte tatsächlich mit einem erhöhten Risiko korrelieren: Bei den analysierten 180.435 zusätzlichen Personen wiesen diejenigen, die besonders jung erkrankten oder häufiger operiert werden mussten, besonders hohe Werte an Risikoscores auf. „Zukünftig könnten diese Angaben uns dabei helfen, Menschen mit erhöhtem Risiko für schwere Ausprägungen frühzeitig zu identifizieren und genauer zu begleiten. Auch könnten die so identifizierten Personen möglicherweise besonders von einer präventiven Lebensweise profitieren“, sagt einer der Co-Autoren, Professor Volker Kahlke, niedergelassener Proktologe in Kiel, von dessen Patientinnen und Patienten ein großer Anteil der zur Validierung genutzten Proben stammen.
Hämorrhoiden offenbar spezifisch für den Menschen
Nicht nur das Hämorrhoidalleiden war bisher wenig erforscht. Auch über die Hämorrhoiden selbst ist bisher nur wenig bekannt. Die Co-Autoren Professor Thilo Wedel und Professor Francois Cossais, Direktoren des Anatomischen Institutes der CAU, haben daher zusätzlich zum Hämorrhoidalleiden beim Menschen vergleichende Untersuchungen an verschiedenen Tierarten durchgeführt, um zu klären, ob bei diesen solche analen Blutgefäßschwellkörper ebenfalls vorhanden sind. Wedel beschäftigt sich schon seit langem mit dem anatomischen Aufbau des Enddarms und des darin eingelagerten Hämorrhoidalplexus. Nun hatte er die Gelegenheit, erstmals Gewebeproben eines Gorillas und eines Pavians zu analysieren. „Während der Mensch über sehr gut entwickelte Hämorrhoidalpolster verfügt, sind diese beim Gorilla und Pavian zunehmend geringer ausgeprägt und bei der Maus gar nicht mehr zu finden, wie wir zeigen konnten. Wahrscheinlich ist dies dem aufrechten Gang des Menschen geschuldet, bei dem ein sicherer Analkanalverschluss besonders wichtig ist,“ fassen Wedel und Cossais zusammen.
Wissenschaftlicher Kontakt:
Prof. Dr. Andre Franke
Institut für Klinische Molekularbiologie
Christian-Albrechts-Universität zu Kiel (CAU), Universitätsklinikum Schleswig-Holstein (UKSH)
0431 500-15110
a.franke@ikmb.uni-kiel.de
Hämorrhoiden sind blutgefüllte, spezielle arteriovenöse "Kissen", die sich im Analkanal befinden und hauptsächlich dem Feinverschluss des Afters dienen und damit zur Stuhlkontinenz beitragen. Vergrößerte Hämorrhoiden (Stadium I-IV) können symptomatisch werden und werden dann als Hämorrhoidalleiden bezeichnet, das in der Bevölkerung sehr häufig vorkommt. Fortgeschrittene symptomatische Stadien von Hämorrhoiden erfordern oft einen chirurgischen Eingriff.
Etwa eine Million DNA-Proben wurden mit modernen Biochips (sogenannten SNP-Arrays) analysiert.
Originalpublikation:
Zheng T, Ellinghaus D, Juzenas S, et al.: Genome-wide analysis of 944,133 individuals provides insights into the etiology of hemorrhoidal disease. Gut (2021). DOI: 10.1136/gutjnl-2020-323868
Über den Exzellencluster PMI
Der Exzellenzcluster „Präzisionsmedizin für chronische Entzündungserkrankungen/Precision Medicine in Chronic Inflammation“ (PMI) wird von 2019 bis 2025 durch die Exzellenzstrategie des Bundes und der Länder gefördert (ExStra). Er folgt auf den Cluster Entzündungsforschung „Inflammation at Interfaces“, der bereits in zwei Förderperioden der Exzellenzinitiative (2007-2018) erfolgreich war. An dem neuen Verbund sind rund 300 Mitglieder in acht Trägereinrichtungen an vier Standorten beteiligt: Kiel (Christian-Albrechts-Universität zu Kiel, Universitätsklinikum Schleswig-Holstein, Muthesius Kunsthochschule, Kiel Institut für Weltwirtschaft (IfW) und Leibniz-Institut für die Pädagogik der Naturwissenschaften und Mathematik), Lübeck (Universität zu Lübeck, Universitätsklinikum Schleswig-Holstein), Plön (Max-Planck-Institut für Evolutionsbiologie) und Borstel (Forschungszentrum Borstel - Leibniz Lungenzentrum).
Ziel ist es, die vielfältigen Forschungsansätze zu chronisch entzündlichen Erkrankungen von Barriereorganen in ihrer Interdisziplinarität verstärkt in die Krankenversorgung zu übertragen und die Erfüllung bisher unbefriedigter Bedürfnisse von Erkrankten voranzutreiben. Drei Punkte sind im Zusammenhang mit einer erfolgreichen Behandlung wichtig und stehen daher im Zentrum der Forschung von PMI: die Früherkennung von chronisch entzündlichen Krankheiten, die Vorhersage von Krankheitsverlauf und Komplikationen und die Vorhersage des individuellen Therapieansprechens.
Pressekontakt:
fbuhse@uv.uni-kiel.de0431/880 4682 https://precisionmedicine.de
Exzellenzcluster „Präzisionsmedizin für chronische Entzündungserkrankungen“
Wissenschaftliche Geschäftsstelle
Leitung: Dr. habil. Susanne Holstein
Christian-Albrechts-Platz 4, D-24118 Kiel
Sonja Petermann
0431/880-4850, Telefax: 0431/880-4894
spetermann@uv.uni-kiel.de
Twitter: PMI @medinflame