Einblicke in den zellulären Ursprung von Gebärmutterhalskrebs
Forschungsteam unter Leitung von CAU-Seniorprofessor Meyer entdeckt zentralen Mechanismus, der den Beginn der Krebsentstehung beeinflusst.
Gebärmutterhalskrebs ist die vierthäufigste Krebsart bei Frauen. Mehr als 90 % davon entstehen in der Übergangszone zwischen dem inneren und dem äußeren Muttermund – einem kritischen Bereich, in dem es verstärkt zu Infektionen und Entzündungen kommt. Bevor an der Übergangszone Krebs entsteht, geht diesem häufig eine Metaplasie voraus. Damit ist ein Prozess gemeint, bei dem die üblicherweise vorhandenen Zelltypen in einem Gewebe durch andere Zelltypen ersetzt werden. Dadurch passt sich das Gewebe an Veränderungen in der lokalen Umgebung an, beispielsweise ernährungsbedingt oder durch äußere Einflüsse wie Infektionen. Trotz ihrer enormen Bedeutung für die Krebsentstehung blieb bisher unklar, wie es genau zu den Metaplasien kommt. Professor Thomas F. Meyer, Seniorprofessor an der Christian-Albrechts-Universität zu Kiel (CAU) und Mitglied im Exzellenzcluster „Precision Medicine in Chronic Inflammation“ (PMI), hat nun gemeinsam mit seinem ehemaligen Forschungsteam vom Max-Planck-Institut (MPI) für Infektionsbiologie in Berlin in Kooperation mit weiteren Forschenden wichtige neue Erkenntnisse über ihre Entstehung vorgelegt. Die Ergebnisse hat das Team vor kurzem in der renommierten Fachzeitschrift Nature Cell Biology veröffentlicht.
In der Übergangszone treffen sich die Zellarten der benachbarten Bereiche
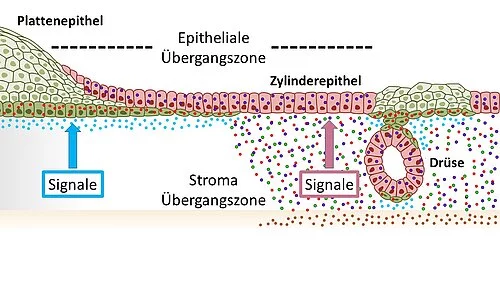
„Wir haben zuerst die Übergangszone im Gebärmutterhals vom inneren zum äußeren Muttermund auf zellulärer Ebene genauer analysiert. Bisher war es wissenschaftlich umstritten, aus welchen Zellarten dieser Übergang besteht“, sagt der federführende Autor und kürzlich ernannte CAU-Seniorprofessor Meyer, der den größten Teil der Forschungsarbeit noch am MPI für Infektionsbiologie in Berlin durchgeführt hat. Dazu haben sie das Gewebe im Labor ausgehend von Stammzellen aus dem Ursprungsgewebe quasi nachgebaut, in sogenannten Organoiden. „Wir konnten zeigen, dass die Übergangszone nicht - wie vielfach angenommen - aus einer eigenen Zellart besteht, sondern dass sich hier die zwei Zellarten der benachbarten Bereiche treffen“, erklärt Meyer weiter. Genauer gesagt sind das die sogenannten Plattenepithelzellen, die den äußeren Gebärmutterhals auskleiden, und die sogenannten Säulenepithelzellen, die sich im inneren Gebärmutterhals finden.
Gegensätzliche Signale regulieren, welche Zellart wo aktiv ist
„Um zu verstehen, wie aus den beiden Zelltypen Metaplasien und letztlich Krebszellen entstehen, ist es wichtig herauszufinden, wie diese Zellen und ihre jeweiligen Entwicklungen reguliert werden“, erklärt die Erstautorin der Arbeit, Dr. Cindrilla Chumduri, ehemals wissenschaftliche Mitarbeiterin am MPI für Infektionsbiologie und seit kurzem Gruppenleiterin am Biozentrum der Universität Würzburg. „Hier haben wir eine überraschende Entdeckung gemacht: Die benachbarten Epithelzelltypen, die sich an der Übergangszone treffen, sind von gegensätzlichen zellbiologischen Signalen abhängig“, so Chumduri weiter. So benötigen die Säulenepithelzellen des inneren Gebärmutterhalses zum Überleben ein bestimmtes Signal, das über den biologisch wichtigen sogenannten Wnt-Signalweg vermittelt wird, während die Plattenepithelzellen des äußeren Teils genau von diesem Signal unterdrückt werden.
Verschiebung der Signale führt zur Metaplasie
„Wir konnten zeigen, dass ein Gradient, also ein unterschiedlich starkes Vorkommen, dieser Signale im Gebärmutterhals in der direkten Umgebung der Zellen dafür sorgt, dass die jeweiligen benachbarten aber unterschiedlichen Zellarten aufrechterhalten werden. Wenn sich diese Signale in eine Richtung verschieben, so verlagert sich auch die eine Gewebeart in Richtung der anderen – es kommt also zu einer Metaplasie“, fasst Erstautor Dr. Rajendra Gurumurthy zusammen, ebenfalls früherer Mitarbeiter am MPI für Infektionsbiologie. Die Forschenden konnten zeigen, dass es im Mausmodell beispielsweise durch einen Vitamin-A-Mangel zu so einer Signalverschiebung kommt: Dadurch wurden Plattenepithelzellen im inneren Gebärmutterhals aktiviert und ersetzten die eigentlich in diesem Bereich ansässigen Säulenepithelzellen.
„Unsere Erkenntnisse helfen, die Mechanismen der Krebsentstehung an diesen Übergangszonen genauer zu verstehen. Sie können dazu beitragen, die Früherkennung von Gebärmutterhalskrebs zu verbessern und präzise Strategien für Prävention und verbesserte Therapien zu entwickeln“, sagt Meyer. „Als nächstes versuchen wir nun die äußeren Einflüsse und Prozesse genauer verstehen zu lernen, die in der unmittelbaren Zellumgebung zu einer Signalveränderung und damit zur Metaplasiebildung führen. Vorläufige Befunde deuten hier auch auf eine mögliche Rolle von Entzündungen hin. Dies werden wir nun in zukünftigen Studien in Kiel, auch gemeinsam mit Kolleginnen und Kollegen des Exzellenzclusters PMI, untersuchen“, so Meyer weiter.
Wissenschaftlicher Kontakt:
Prof. Dr. Thomas F. Meyer
Arbeitsgruppe Infektionsonkologie
Institut für klinische Molekularbiologie (IKMB)
Christian-Albrechts-Universität zu Kiel und Universitätsklinikum Schleswig-Holstein
t.meyer@ikmb.uni-kiel.de
Illustration des Gewebes im Gebärmutterhals mit Plattenepithelien (grün) des äußeren Muttermunds (ektozervikal) und Säulenepithelien (rot) des inneren Muttermunds (endozervikal), die an der Übergangszone ineinander übergehen. Die entgegengesetzte Wnt-Signalumgebung hält diese Verteilung aufrecht. Eine Veränderung hin zu Signalen, bei denen der Wnt-Signalweg unterdrückt wird, im endozervikalen Stroma fördert die Entstehung von Plattenepithelmetaplasien.
Originalpublikation:
C. Chumduri*, R. K. Gurumurthy*…T. F. Meyer: Opposing Wnt signals regulate cervical squamocolumnar homeostasis and emergence of metaplasia. Nature Cell Biology (2021). https://doi.org/10.1038/s41556-020-00619-0
*Diese Autor*innen trugen in gleichem Maße zur Arbeit bei.
Über den Exzellencluster PMI
Der Exzellenzcluster „Präzisionsmedizin für chronische Entzündungserkrankungen/Precision Medicine in Chronic Inflammation“ (PMI) wird von 2019 bis 2025 durch die Exzellenzstrategie des Bundes und der Länder gefördert (ExStra). Er folgt auf den Cluster Entzündungsforschung „Inflammation at Interfaces“, der bereits in zwei Förderperioden der Exzellenzinitiative (2007-2018) erfolgreich war. An dem neuen Verbund sind rund 300 Mitglieder in acht Trägereinrichtungen an vier Standorten beteiligt: Kiel (Christian-Albrechts-Universität zu Kiel, Universitätsklinikum Schleswig-Holstein, Muthesius Kunsthochschule, Kiel Institut für Weltwirtschaft (IfW) und Leibniz-Institut für die Pädagogik der Naturwissenschaften und Mathematik), Lübeck (Universität zu Lübeck, Universitätsklinikum Schleswig-Holstein), Plön (Max-Planck-Institut für Evolutionsbiologie) und Borstel (Forschungszentrum Borstel - Leibniz Lungenzentrum).
Ziel ist es, die vielfältigen Forschungsansätze zu chronisch entzündlichen Erkrankungen von Barriereorganen in ihrer Interdisziplinarität verstärkt in die Krankenversorgung zu übertragen und die Erfüllung bisher unbefriedigter Bedürfnisse von Erkrankten voranzutreiben. Drei Punkte sind im Zusammenhang mit einer erfolgreichen Behandlung wichtig und stehen daher im Zentrum der Forschung von PMI: die Früherkennung von chronisch entzündlichen Krankheiten, die Vorhersage von Krankheitsverlauf und Komplikationen und die Vorhersage des individuellen Therapieansprechens.
Pressekontakt:
fbuhse@uv.uni-kiel.de0431/880 4682 https://precisionmedicine.de
Exzellenzcluster „Präzisionsmedizin für chronische Entzündungserkrankungen“
Wissenschaftliche Geschäftsstelle
Leitung: Dr. habil. Susanne Holstein
Christian-Albrechts-Platz 4, D-24118 Kiel
Sonja Petermann
0431/880-4850, Telefax: 0431/880-4894
spetermann@uv.uni-kiel.de
Twitter: PMI @medinflame